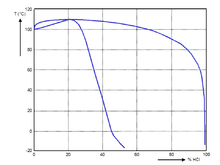
20℃时不同浓度盐酸的物理性质数据:
| 质量分数 | 浓度 | 密度(Kg/L) | 物质的量浓度 | 哈米特酸度函数 | 粘性 | 比热容 | 蒸汽压 | 沸点 | 熔点 |
| (g/L) | (mol/L) | (m·Pa·s) | [KJ/(Kg·℃)] | (Pa) | (℃) | (℃) | |||
| 10% | 104.8 | 1.048 | 2.87 | -0.5 | 1.16 | 3.47 | 0.527 | 103 | -18 |
| 20% | 219.6 | 1.098 | 6.02 | -0.8 | 1.37 | 2.99 | 27.3 | 108 | -59 |
| 30% | 344.7 | 1.149 | 9.45 | -1 | 1.7 | 2.6 | 1410 | 90 | -52 |
| 32% | 370.88 | 1.159 | 10.17 | -1 | 1.8 | 2.55 | 3130 | 84 | -43 |
| 34% | 397.46 | 1.169 | 10.9 | -1 | 1.9 | 2.5 | 6733 | 71 | -36 |
| 36% | 424.44 | 1.179 | 11.64 | -1.1 | 1.99 | 2.46 | 14100 | 61 | -30 |
| 38% | 451.82 | 1.189 | 12.39 | -1.1 | 2.1 | 2.43 | 28000 | 48 | -26 |
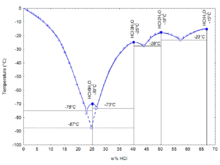
如下图所示,盐酸共有四个结晶的共熔点,分别对应四种晶体:68%(HCl的质量分数,下同)时的HCl·H2O、51%时的HCl·2H2O、41%时的HCl·3H2O和25%时的HCl·6H2O。另外在24.8%时还有一种亚稳的HCl·3H2O生成。
酸性
盐酸溶于碱液时与碱液发生中和反应。
盐酸是一种一元强酸,这意味着它只能电离出一个
在水溶液中氯化氢分子完全电离
与一个水分子络合,成为H3O+,使得水溶液显酸性:
盐酸可以与氢氧化钠酸碱中和,产生食盐:
一元酸只有一个酸离解常数,符号为Ka。它能够度量水溶液中酸的强度。于盐酸等强酸而言,Ka很大,只能通过理论计算来求得。向盐酸溶液中加入氯化物(比如NaCl)时pH基本不变,这是因为Cl-是盐酸的共轭碱,强度极弱。所以在计算时,若不考虑极稀的溶液,可以假设氢离子的物质的量浓度与原氯化氢浓度相同。如此做即使精确到四位有效数字都不会有误差。
还原性
盐酸具有还原性,可以和一些强氧化剂反应,放出氯气:
二氧化锰:
配位性
部分金属化合物溶于盐酸后,金属离子会与氯离子络合。例如难溶于冷水的二氯化铅可溶于盐酸:
酸性环境下可对醇类进行亲核取代生成卤代烃:
此外,胺的盐酸盐的熔点或分解点可以用来测定胺的种类。
锌粒与氯化汞在稀盐酸中反应可以制得锌汞齐,后者与浓盐酸、醛或酮一起回流可将醛酮的羰基还原为亚甲基,是为克莱门森还原反应:

